Exemplos De Inibidores Competitivos E Não Competitivos: mergulhe no fascinante mundo da inibição enzimática, explorando como diferentes moléculas podem afetar a atividade de enzimas, essenciais para a vida. Este guia irá desvendar os mecanismos de inibição competitiva e não competitiva, mostrando como esses processos influenciam a velocidade das reações e abrem portas para aplicações inovadoras em áreas como medicina e indústria.
A inibição enzimática é um processo fundamental na bioquímica, onde a atividade de uma enzima é reduzida ou bloqueada por uma molécula, chamada de inibidor. Os inibidores podem atuar de maneiras diferentes, interferindo na capacidade da enzima de se ligar ao seu substrato e catalisar a reação.
A inibição competitiva ocorre quando o inibidor compete com o substrato pelo mesmo sítio ativo na enzima. Já a inibição não competitiva acontece quando o inibidor se liga a um sítio diferente do sítio ativo, alterando a conformação da enzima e prejudicando sua atividade.
Introdução à Inibição Enzimática
A inibição enzimática é um processo fundamental na bioquímica que envolve a redução da atividade de uma enzima, diminuindo a velocidade de uma reação química específica. Essa inibição pode ocorrer por meio de diferentes mecanismos, cada um com suas características e implicações.
Compreender os princípios da inibição enzimática é crucial para entender o funcionamento de sistemas biológicos e para o desenvolvimento de fármacos e outros compostos que podem modular a atividade enzimática.
Tipos de Inibição Enzimática
A inibição enzimática pode ser classificada em diferentes tipos, com base no mecanismo pelo qual o inibidor interfere na atividade da enzima. Dois tipos principais são a inibição competitiva e a inibição não competitiva.
Inibição Competitiva
A inibição competitiva é um tipo de inibição enzimática em que o inibidor compete com o substrato pelo sítio ativo da enzima. Essa competição ocorre porque o inibidor possui uma estrutura semelhante à do substrato, permitindo que ele se ligue ao sítio ativo da enzima, impedindo a ligação do substrato e a catálise da reação.
Mecanismo de Ação da Inibição Competitiva
O mecanismo de ação da inibição competitiva é baseado na competição entre o inibidor e o substrato pelo sítio ativo da enzima. O inibidor, por ter uma estrutura semelhante ao substrato, consegue se ligar ao sítio ativo da enzima, formando um complexo enzima-inibidor (EI).
A formação desse complexo impede a ligação do substrato ao sítio ativo da enzima, diminuindo a velocidade da reação. No entanto, a inibição competitiva é reversível, ou seja, o inibidor pode se desligar do sítio ativo, permitindo que o substrato se ligue e a reação ocorra.
A presença de um inibidor competitivo afeta a cinética enzimática, levando a um aumento no valor da constante de Michaelis-Menten (Km) da enzima. Isso significa que é necessária uma concentração maior do substrato para atingir metade da velocidade máxima da reação na presença do inibidor.
No entanto, a velocidade máxima (Vmax) da reação permanece inalterada, pois a inibição competitiva não afeta a capacidade da enzima de catalisar a reação quando o substrato está ligado ao sítio ativo.
A inibição competitiva é caracterizada por um aumento no valor de Km e a Vmax permanece inalterada.
Exemplos de Inibidores Competitivos
Existem diversos exemplos de inibidores competitivos em diferentes áreas da bioquímica e da medicina. Alguns exemplos incluem:
- Metotrexato: Um inibidor competitivo da enzima di-hidrofolato redutase (DHFR), que é essencial para a síntese de DNA e RNA. O metotrexato é usado no tratamento de câncer e doenças autoimunes.
- Estatinas: Uma classe de fármacos que inibem a enzima HMG-CoA redutase, que é responsável pela síntese de colesterol. As estatinas são usadas para reduzir os níveis de colesterol no sangue e prevenir doenças cardíacas.
- Sulfanilamidas: Uma classe de antibióticos que inibem a enzima di-hidrofolato sintetase, que é essencial para a síntese de folato em bactérias. As sulfanilamidas são usadas para tratar infecções bacterianas.
Comparação de Inibidores Competitivos
A tabela a seguir compara as características de diferentes inibidores competitivos:
| Nome do Inibidor | Estrutura Química | Mecanismo de Ação | Exemplos de Aplicações |
|---|---|---|---|
| Metotrexato | [Estrutura Química do Metotrexato] | Inibe a di-hidrofolato redutase (DHFR), bloqueando a síntese de DNA e RNA. | Tratamento de câncer e doenças autoimunes. |
| Estatinas (Atorvastatina) | [Estrutura Química da Atorvastatina] | Inibe a HMG-CoA redutase, diminuindo a síntese de colesterol. | Redução dos níveis de colesterol no sangue e prevenção de doenças cardíacas. |
| Sulfanilamidas (Sulfadiazina) | [Estrutura Química da Sulfadiazina] | Inibe a di-hidrofolato sintetase, bloqueando a síntese de folato em bactérias. | Tratamento de infecções bacterianas. |
| Inibidores da Monoamina Oxidase (MAOIs) (Tranilcipromina) | [Estrutura Química da Tranilcipromina] | Inibem a monoamina oxidase, uma enzima que degrada neurotransmissores como a serotonina, dopamina e noradrenalina. | Tratamento de depressão e outros distúrbios psiquiátricos. |
Inibição Não Competitiva: Exemplos De Inibidores Competitivos E Não Competitivos
A inibição não competitiva é um tipo de inibição enzimática onde o inibidor se liga a um sítio diferente do sítio ativo da enzima, alterando sua conformação e diminuindo sua atividade catalítica. Essa ligação não é afetada pela concentração do substrato.
Mecanismo de Ação da Inibição Não Competitiva
O inibidor não competitivo se liga a um sítio alostérico da enzima, que é um sítio diferente do sítio ativo. Essa ligação causa uma mudança na conformação da enzima, o que pode afetar a capacidade do sítio ativo de se ligar ao substrato ou a capacidade da enzima de catalisar a reação.
O inibidor não competitivo se liga a um sítio diferente do sítio ativo da enzima, alterando sua conformação e diminuindo sua atividade catalítica.
A ligação do inibidor não competitivo não é afetada pela concentração do substrato. Isso significa que o inibidor pode se ligar à enzima, mesmo na ausência do substrato.
Exemplos de Inibidores Não Competitivos
Existem muitos exemplos de inibidores não competitivos, incluindo:
- Iodoacetato: Um agente alquilante que reage com grupos sulfidrila de cisteínas em enzimas, levando à inativação.
- Cianeto: Um inibidor não competitivo da citocromo oxidase, uma enzima envolvida na cadeia respiratória. O cianeto se liga ao íon ferro do grupo heme na citocromo oxidase, impedindo a transferência de elétrons.
- Mercúrio: Um inibidor não competitivo que se liga a grupos sulfidrila de enzimas, levando à inativação.
- Arsênico: Um inibidor não competitivo que se liga a grupos sulfidrila de enzimas, levando à inativação.
Comparação de Inibidores Não Competitivos
| Nome do Inibidor | Estrutura Química | Mecanismo de Ação | Exemplos de Aplicações ||—|—|—|—|| Iodoacetato | CH2ICOOH | Alquilação de grupos sulfidrila de cisteínas em enzimas | Inativação de enzimas, pesquisa bioquímica || Cianeto | CN- | Ligação ao íon ferro do grupo heme na citocromo oxidase | Intoxicação, pesquisa bioquímica || Mercúrio | Hg2+ | Ligação a grupos sulfidrila de enzimas | Intoxicação, pesquisa bioquímica || Arsênico | As3+ | Ligação a grupos sulfidrila de enzimas | Intoxicação, pesquisa bioquímica |
Comparação entre Inibição Competitiva e Não Competitiva
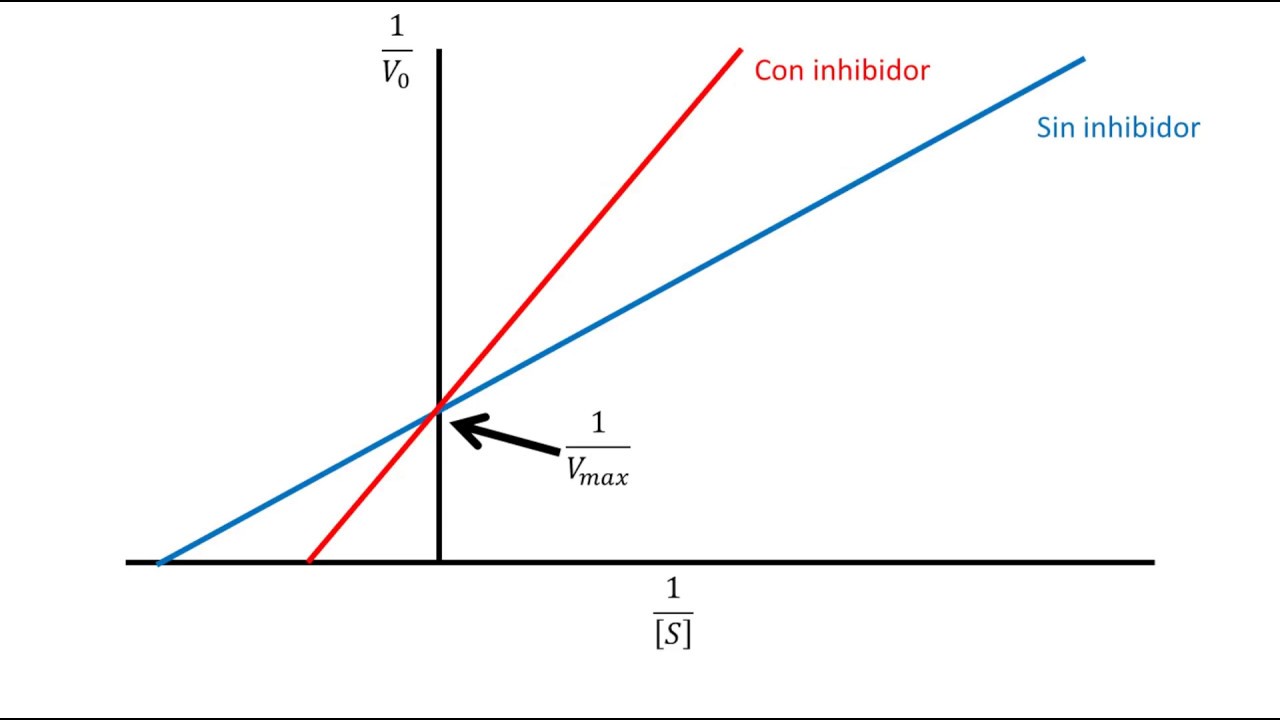
A inibição enzimática é um processo fundamental na regulação da atividade enzimática. Compreender os diferentes tipos de inibição é crucial para o desenvolvimento de medicamentos e o estudo de processos biológicos. A inibição competitiva e a inibição não competitiva são dois dos tipos mais comuns de inibição enzimática, cada um com suas características únicas e impactos na atividade enzimática.
Comparação das Características Chave
A inibição competitiva e a inibição não competitiva diferem em seus mecanismos de ação e efeitos na atividade enzimática. A principal diferença reside no local de ligação do inibidor.
- Na inibição competitiva, o inibidor se liga ao mesmo sítio ativo da enzima que o substrato, competindo com o substrato pela ligação ao sítio ativo.
- Na inibição não competitiva, o inibidor se liga a um sítio diferente do sítio ativo da enzima, chamado de sítio alostérico. Essa ligação altera a conformação da enzima, diminuindo sua afinidade pelo substrato.
Efeitos da Concentração do Substrato e do Inibidor
A concentração do substrato e do inibidor tem um impacto significativo na atividade enzimática em ambos os tipos de inibição.
- Na inibição competitiva, o aumento da concentração do substrato pode superar a inibição, pois o substrato compete mais efetivamente pelo sítio ativo.
- Na inibição não competitiva, o aumento da concentração do substrato não consegue superar a inibição, pois o inibidor se liga a um sítio diferente e afeta a conformação da enzima, independentemente da concentração do substrato.
- Em ambos os tipos de inibição, o aumento da concentração do inibidor aumenta a inibição enzimática.
Curvas de Michaelis-Menten, Exemplos De Inibidores Competitivos E Não Competitivos
As curvas de Michaelis-Menten são usadas para representar graficamente a relação entre a velocidade da reação enzimática e a concentração do substrato. As curvas de Michaelis-Menten para reações enzimáticas com e sem inibidores competitivos e não competitivos mostram as diferenças características entre os dois tipos de inibição.
- Na inibição competitiva, a curva de Michaelis-Menten é deslocada para a direita, com um aumento aparente no valor de Km, mas a Vmax permanece a mesma. Isso ocorre porque o inibidor competitivo diminui a afinidade da enzima pelo substrato, requerendo uma concentração mais alta do substrato para atingir metade da velocidade máxima.
- Na inibição não competitiva, a curva de Michaelis-Menten é deslocada para baixo, com uma diminuição na Vmax, mas o Km permanece o mesmo. Isso ocorre porque o inibidor não competitivo reduz a atividade catalítica da enzima, diminuindo a velocidade máxima da reação, mas não afeta a afinidade da enzima pelo substrato.
A inibição competitiva e a inibição não competitiva são mecanismos importantes na regulação da atividade enzimática. Compreender as diferenças entre esses dois tipos de inibição é crucial para a compreensão de processos biológicos e o desenvolvimento de medicamentos.
Aplicações de Inibidores Competitivos e Não Competitivos
Os inibidores enzimáticos, tanto competitivos como não competitivos, desempenham papéis cruciais na medicina, indústria e pesquisa, sendo utilizados para uma variedade de fins, desde o tratamento de doenças até o desenvolvimento de novos medicamentos e a investigação científica.
Aplicações na Medicina
A inibição enzimática é um princípio fundamental na medicina, sendo utilizada no desenvolvimento de medicamentos para tratar uma vasta gama de doenças.
- Inibidores competitivos:
- Tratamento de doenças cardíacas:Os inibidores da enzima conversora de angiotensina (ECA), como o captopril e o enalapril, são inibidores competitivos que bloqueiam a conversão da angiotensina I em angiotensina II, um potente vasoconstritor. Essa inibição reduz a pressão arterial, prevenindo ataques cardíacos e derrames.
- Tratamento de infecções bacterianas:As sulfonamidas, como a sulfadiazina e a sulfametoxazol, são inibidores competitivos que interferem na síntese de ácido fólico nas bactérias, essencial para o seu crescimento e reprodução.
- Tratamento de gota:O alopurinol, um inibidor competitivo da xantina oxidase, é utilizado no tratamento da gota, uma doença causada pela acumulação de ácido úrico nas articulações. O alopurinol reduz a produção de ácido úrico, aliviando a dor e a inflamação.
- Inibidores não competitivos:
- Tratamento de câncer:Os inibidores não competitivos da di-hidrofolato redutase, como o metotrexato, são utilizados no tratamento de certos tipos de câncer, como leucemia e linfoma. Esses inibidores bloqueiam a síntese de purinas, essenciais para o crescimento e proliferação celular.
- Tratamento de doenças autoimunes:Os inibidores não competitivos da ciclooxigenase (COX), como o ibuprofeno e o naproxeno, são utilizados no tratamento de doenças inflamatórias, como artrite reumatoide e osteoartrite. Esses inibidores bloqueiam a produção de prostaglandinas, mediadores inflamatórios.
Aplicações na Indústria
Os inibidores enzimáticos também são utilizados em diversos processos industriais, como na produção de alimentos, bebidas, produtos farmacêuticos e outros produtos químicos.
- Produção de alimentos:Os inibidores enzimáticos são utilizados para controlar a maturação de frutas e vegetais, aumentar a vida útil dos alimentos e melhorar a qualidade do produto final.
- Inibidores de polifenoloxidase:São utilizados para evitar o escurecimento de frutas e vegetais, como maçãs, bananas e batatas, durante o processamento e armazenamento.
- Inibidores de proteases:São utilizados para tenderizar a carne, controlar a textura de produtos lácteos e melhorar a estabilidade de produtos de panificação.
- Produção de produtos farmacêuticos:Os inibidores enzimáticos são utilizados no desenvolvimento de medicamentos para tratar doenças, como as já mencionadas, e também para sintetizar novos fármacos.
- Inibidores de HIV protease:São utilizados no tratamento da infecção pelo vírus HIV, bloqueando a produção de novas partículas virais.
- Inibidores de tirosina quinase:São utilizados no tratamento de certos tipos de câncer, bloqueando a sinalização celular que promove o crescimento tumoral.
Aplicações na Pesquisa
Os inibidores enzimáticos são ferramentas essenciais na pesquisa científica, utilizados para estudar o mecanismo de ação de enzimas, desenvolver novos fármacos e investigar o papel de enzimas em doenças.
- Estudos mecanísticos:Os inibidores enzimáticos são utilizados para determinar a estrutura e função de enzimas, elucidando o mecanismo de ação de reações catalíticas.
- Estudos cinéticos:A determinação das constantes cinéticas de inibição fornece informações sobre a interação entre o inibidor e a enzima, bem como sobre o mecanismo de inibição.
- Estudos estruturais:A utilização de inibidores em estudos de cristalografia de raios X pode ajudar a elucidar a estrutura tridimensional da enzima e o sítio ativo onde o inibidor se liga.
- Desenvolvimento de novos fármacos:Os inibidores enzimáticos são utilizados como protótipos para o desenvolvimento de novos medicamentos, otimizando a estrutura e atividade do inibidor para aumentar a sua eficácia e segurança.
- Estudos de triagem:A utilização de bibliotecas de inibidores em estudos de triagem permite a identificação de novos compostos com atividade inibitória contra enzimas alvo.
- Otimização de compostos:A otimização da estrutura do inibidor através de métodos de química medicinal pode levar ao desenvolvimento de compostos com maior afinidade, seletividade e potência.
- Investigação de doenças:Os inibidores enzimáticos são utilizados para investigar o papel de enzimas em doenças, identificando potenciais alvos para o desenvolvimento de novos medicamentos.
- Estudos de expressão gênica:A análise da expressão de genes que codificam enzimas alvo em células e tecidos doentes pode ajudar a elucidar o papel da enzima na doença.
- Estudos de validação de alvos:A utilização de inibidores em modelos animais de doenças pode ajudar a validar a enzima como um alvo terapêutico e avaliar a eficácia do inibidor.
Ao compreender os mecanismos de inibição competitiva e não competitiva, podemos desenvolver estratégias para controlar a atividade enzimática e, consequentemente, regular processos biológicos. O estudo de inibidores enzimáticos tem um impacto direto no desenvolvimento de medicamentos, na otimização de processos industriais e na pesquisa científica.
Explorar este campo nos permite desvendar os segredos da vida e abrir caminho para novas descobertas e aplicações.

